Principiul de funcționare a bateriei
Cum funcționează un ceas de perete, o telecomandă TV sau o jucărie pentru copii radiocontrolată? Majoritatea oamenilor, fără ezitare, vor răspunde „din baterii” și, în principiu, vor avea dreptate. Dar este puțin probabil ca vreunul dintre ei să poată spune cât de exact este triplat bateria portabilă, cum funcționează și fără de care întregul proces de transmitere a curentului electric de la baterie la consumatorul final ar fi imposibil. Să umplem acest gol enervant în cunoștințe.
Conținutul articolului
Principiul de funcționare a bateriei
Pentru a înțelege principiul de funcționare al unei baterii AA convenționale, trebuie să aveți o înțelegere generală a structurii acesteia. Deci, orice baterie constă din trei elemente principale - anod, catod și electrolit. Mai mult, acesta din urmă poate avea practic orice stare de agregare: catodul și anodul plasate într-o soluție salină, în principiu, sunt, de asemenea, o „baterie”, doar într-o formă neobișnuită pentru omul obișnuit.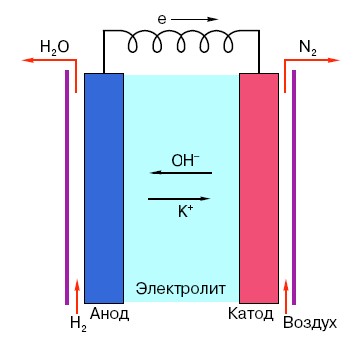
Interesant! Așa-numita „coloană voltaică”, inventată de Alessandro Volta, avea și ea toate elementele necesare pentru producerea curentului electric. Era alcătuită din plăci de zinc și cupru stivuite una peste alta, între care o cârpă înmuiată în acid era așezată ca „strat”.
Anodul din astfel de sisteme este principala sursă de electroni, care, după cum știm dintr-un curs de fizică școlar, au o sarcină negativă.Particulele încărcate negativ sunt atrase de cele pozitive, iar în acest caz suprafața catodului acționează ca un „plus”.
Dar acest lucru nu este suficient pentru ca un curent electric să apară, deoarece electronii au nevoie și de un fel de „autostradă” - un mediu care să susțină interacțiunea catodului și anodului. Aici apare un electrolit „pe scenă” - o sare, un alcalin sau un acid capabil să conducă curentul.
Să ne uităm la principiul de funcționare folosind un exemplu specific: există o baterie evaluată la 18 volți. Tensiunea dintre electrozii din acesta este stabilă până când este conectată la rețea. De îndată ce apare un consumator (de exemplu, un bec obișnuit), tensiunea începe să scadă treptat, curentul începe să curgă de la electrodul „negativ” la cel „pozitiv” și are loc o reacție chimică în electrolitul care vizează menținerea diferenței de potențial dintre electrozi.
Referinţă. Cu cât consumatorul are nevoie de mai multă energie, cu atât reacția în interiorul bateriei este mai intensă și va eșua mai repede.
Cum funcționează o baterie reîncărcabilă, cum diferă de una obișnuită
Așadar, ne-am uitat la clasicele baterii „deget” și „degetul mic” și știm că durata de viață a celor mai multe dintre ele este strict limitată (indiferent ce spun producătorii celebri). Dar cum rămâne cu așa-numitele baterii - baterii de tip baterie care nu numai că pot consuma energie în timpul procesului de reacție, dar și o pot acumula și o pot stoca pentru o lungă perioadă de timp?
Pentru a înțelege principiul de funcționare al bateriei, este necesar să apelăm la chimie. Să luăm ca exemplu... Un foc obișnuit cu cărbune.Oricât de frumoasă și fascinantă arată flacăra, orice chimist care o observă știe că acest proces este doar o reacție pe termen lung de oxidare a combustibilului. Cărbunele care arde interacționează cu oxigenul și ca urmare a acestei reacții obținem:
- dioxid de carbon;
- ușoară;
- cald.
Și dacă ultimele două puncte sunt capabile să încălzească sufletul și corpul, atunci nu putem folosi dioxidul de carbon în niciun fel, deoarece este un produs secundar al reacției, care este, de fapt, deșeul său. Reacția de oxidare se oprește atunci când elementele de pornire: oxigen și cărbune se epuizează. Oprirea reacției într-o baterie are loc exact în același mod atunci când substanțele de pornire sunt complet epuizate și rămân doar „deșeuri”.
În baterie, totul se întâmplă puțin diferit. Cert este că reacția care are loc în ea aparține categoriei de reversibile, adică în anumite condiții poate fi „inversată”, readucerea tuturor substanțelor la starea lor inițială. Este posibilitatea ca în baterie să apară o reacție reversibilă care permite încărcarea acesteia.
Într-o baterie conectată la rețea, reacția are loc în direcția opusă, iar curentul trece de la „plus” la „minus”, și nu invers. Ca urmare, produsul de reacție formează substanțele de pornire, iar proprietarul bateriei primește energia disponibilă „recuperată” într-un format portabil. Asta e tot!





